CARAVAGGIO-News: Was Sie jetzt wissen müssen!
Apixaban wurde im Rahmen der CARAVAGGIO-Studie an einem breiten Kollektiv bei Krebspatient:innen zur Behandlung venöser Thromboembolien (VTE) untersucht. Aktuelle Daten aus dem Versorgungsalltag komplementierten diese Ergebnisse. All diese Daten wurden insbesondere nach 6-monatiger Antikoagulation erfasst. Doch ist Apixaban auch in früheren Behandlungsphasen wirksam und hat ein gutes Sicherheitsprofil?
Venöse Thromboembolien (VTE: Tiefe Venenthrombosen (TVT) und/oder Lungenembolien (LE)) sind eine häufige Komplikation bei Patient:innen mit Krebserkrankung1 und stellen in dieser Population die zweithäufigste Todesursache dar.2 Selbst unter Antikoagulation haben Krebspatient:innen ein gegenüber Patient:innen ohne Krebserkrankung gesteigertes Risiko für VTE bzw. VTE-Rezidive sowie für schwere Blutungen.3 Wichtig ist daher eine effektive und verträgliche Antikoagulation. In der CARAVAGGIO-Studie hat sich Apixaban in der Behandlung krebsassoziierter VTE als wirksame orale Alternative mit gutem Sicherheitsprofil zu den subkutan zu verabreichenden niedermolekularen Heparinen (NMH) erwiesen.4
Näheres zur CARAVAGGIO-Studie4 entnehmen Sie bitte nachfolgendem Akkordeon oder dieser Infografik.
Die multinationale, prospektive, randomisierte (1:1), offene Studie mit verblindeter Endpunktauswertung (PROBE-Design) evaluierte über sechs Monate die Wirksamkeit und Sicherheit von
-
Apixaban (10 mg 2 x täglich bis Tag 7, gefolgt von 5 mg 2 x täglich)*; n = 576
- versus Dalteparin (200 I.E./kg Körpergewicht [KG] 1 x täglich bis Tag 30, dann 150 I.E./kg KG 1 x täglich); n = 579
bei erwachsenen Krebspatient:innen† mit neu diagnostizierter (akut oder inzidentell), proximaler tiefer Venenthrombose (TVT) der unteren Extremität und/oder Lungenembolie (LE).4
Behandelt wurde über 6 Monate mit einer anschließenden Nachbeobachtungszeit von 30 Tagen.4
Ergebnisse
- Primärer Wirksamkeitsendpunkt VTE-Rezidive: Zu VTE-Rezidiven kam es unter Apixaban bei 5,6 % der Patient:innen versus 7,9 % unter Dalteparin (HR 0,63; 95 %-KI: 0,37-1,07; p < 0,001 für Nicht-Unterlegenheit und p = 0,09 für Überlegenheit).
- Haupt-Sicherheitsendpunkt schwere Blutungen‡: Die Rate schwerer Blutungen war mit 3,8 % (Apixaban) versus 4,0 % (Dalteparin) vergleichbar (HR 0,82; 95 %-KI 0,40-1,69; p = 0,60).
-
Schwere gastrointestinale (GI-) Blutungen: Die Rate schwerer GI-Blutungen war mit 1,9 % (Apixaban) versus 1,7 % (Dalteparin) vergleichbar (HR = 1,05; 95 %-KI: 0,44-2,50).
Apixaban ist für ein breites Kollektiv an Krebspatient:innen geeignet – auch im Versorgungsalltag!
Subgruppenanalysen5–7 der Studie CARAVAGGIO4 zeigten, dass Patient:innen mit krebsassoziierter VTE unabhängig von der gleichzeitigen medikamentösen Krebstherapie, der Tumorlokalisation oder einer moderaten Nierenfunktionsstörung (eGFR < 60 ml/min und ≥ 30 ml/min) von Apixaban profitieren können.
Auf Basis der CARAVAGGIO-Daten hat die CHEST-Guideline 2021 Apixaban neben NMH als bevorzugte Option zur VTE-Behandlung von Patient:innen mit luminalen GI-Tumoren deklariert.8 Daten aus dem US-Versorgungsalltag§ ergänzen das gute Wirksamkeits- und Sicherheitsprofil von Apixaban aus der klinischen Studie CARAVAGGIO4 bei der Behandlung krebsassoziierter VTE ‒ auch bei Hochrisiko-Patient:innen mit gleichzeitiger Krebsbehandlung/Chemotherapie oder mit GI-Tumoren.9, 10
Doch sowohl die CARAVAGGIO-Studie als auch die retrospektiven Beobachtungsstudien analysierten die Ergebnisse ausschließlich nach 6-monatiger Antikoagulation.4, 9 Wie sieht es aber mit der Wirksamkeit und Sicherheit von Apixaban im frühen Zeitverlauf, z. B. nach der initialen 7-tägigen Behandlungsphase mit der Hochdosis von Apixaban (10 mg 2x täglich), aus?
Apixaban ist auch in der frühen Behandlungsphase (<6 Monate) wirksam mit gutem Sicherheitsprofil
Eine Subanalyse11 der CARAVAGGIO-Studie4 ging der Frage nach, wie häufig VTE-Rezidive, schwere Blutungen‡ sowie schwere‡ oder CRNM-Blutungen unter Apixaban vs. Dalteparin bei Patient:innen mit krebsassoziierter VTE nach 7, 30 und 90 Behandlungstagen auftraten. Die Proband:innen erhielten ab Tag 1 bis einschließlich Tag 7 gemäß Fachinformation Apixaban 10 mg 2x täglich; anschließend wurde die Dosis* auf 5 mg 2 x täglich angepasst.11 Das Resultat der Subanalyse11 unterstützt die Ergebnisse der CARAVAGGIO-Hauptanalyse:4 Demnach kann Apixaban - auch in der frühen Behandlungsphase - bei Patient:innen mit krebsassoziierter VTE eine vergleichbar wirksame VTE-Behandlung und bzgl. schwerer Blutungen‡ vergleichbar verträgliche orale Alternative zu NMH darstellen.
Näheres zu den Wirksamkeits- und Sicherheitsergebnissen der CARAVAGGIO-Subanalyse von Cohen et al.11 entnehmen Sie bitte nachfolgendem Akkordeon.
Ergebnisse der CARAVAGGIO-Subanalyse11
Wirksamkeitsergebnisse**
- Vergleichbare Raten für VTE-Rezidive nach 7, 30 und 90 Behandlungstagen (Abb.1):11
- VTE-Rezidive traten nach 7, 30 und 90 Tagen bei 6 (1 %), 15 (2,6 %) und 27 (4,7 %) Patient:innen in der Apixaban-Gruppe gegenüber 5 (0,9 %), 20 (3,5 %) und 36 (6,2 %) Patient:innen in der Dalteparin-Gruppe auf.
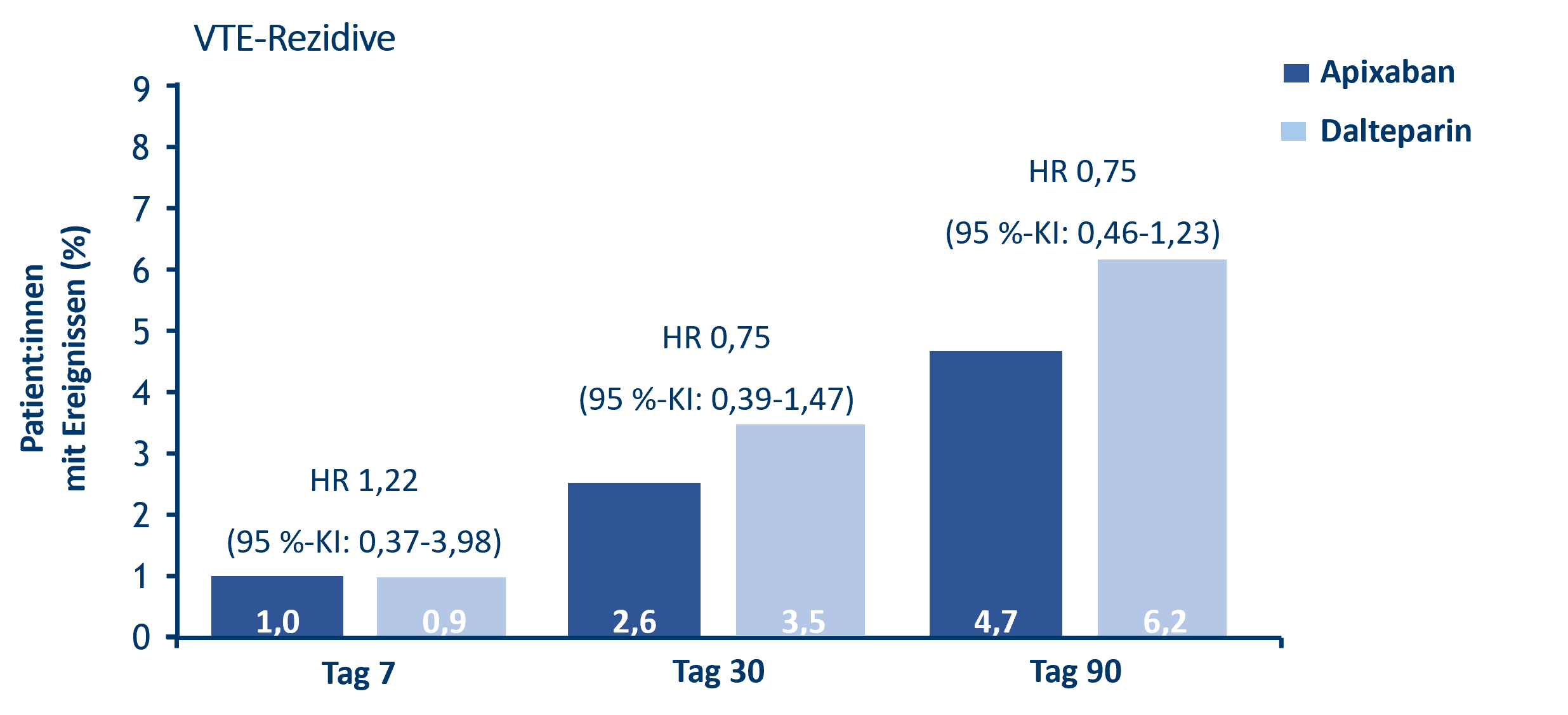
Abb. 1: CARAVAGGIO-Subanalyse: VTE-Rezidive unter Apixaban versus Dalteparin, modifiziert nach Cohen et al.11
Sicherheitsergebnisse**
- Vergleichbare Raten für schwere Blutungen‡ sowie schwere‡ oder CRNM-Blutungen unter Apixaban vs. Dalteparin nach 7, 30 und 90 Behandlungstagen:11
- Schwere Blutungen‡ traten nach 7, 30 und 90 Tagen bei 3 (0,5 %), 9 (1,6 %) und 16 (2,8 %) Patient:innen in der Apixaban-Gruppe gegenüber 5 (0,9 %), 11 (1,9 %) und 17 (2,9 %) Patient:innen in der Dalteparin-Gruppe auf.
- Schwere‡ oder CRNM-Blutungen traten nach 7, 30 und 90 Tagen bei 14 (2,4 %), 30 (5,2 %) und 46 (8,0 %) Patient:innen in der Apixaban-Gruppe gegenüber 10 (1,7 %), 28 (4,8 %) und 43 (7,4 %) Patient:innen in der Dalteparin-Gruppe auf.
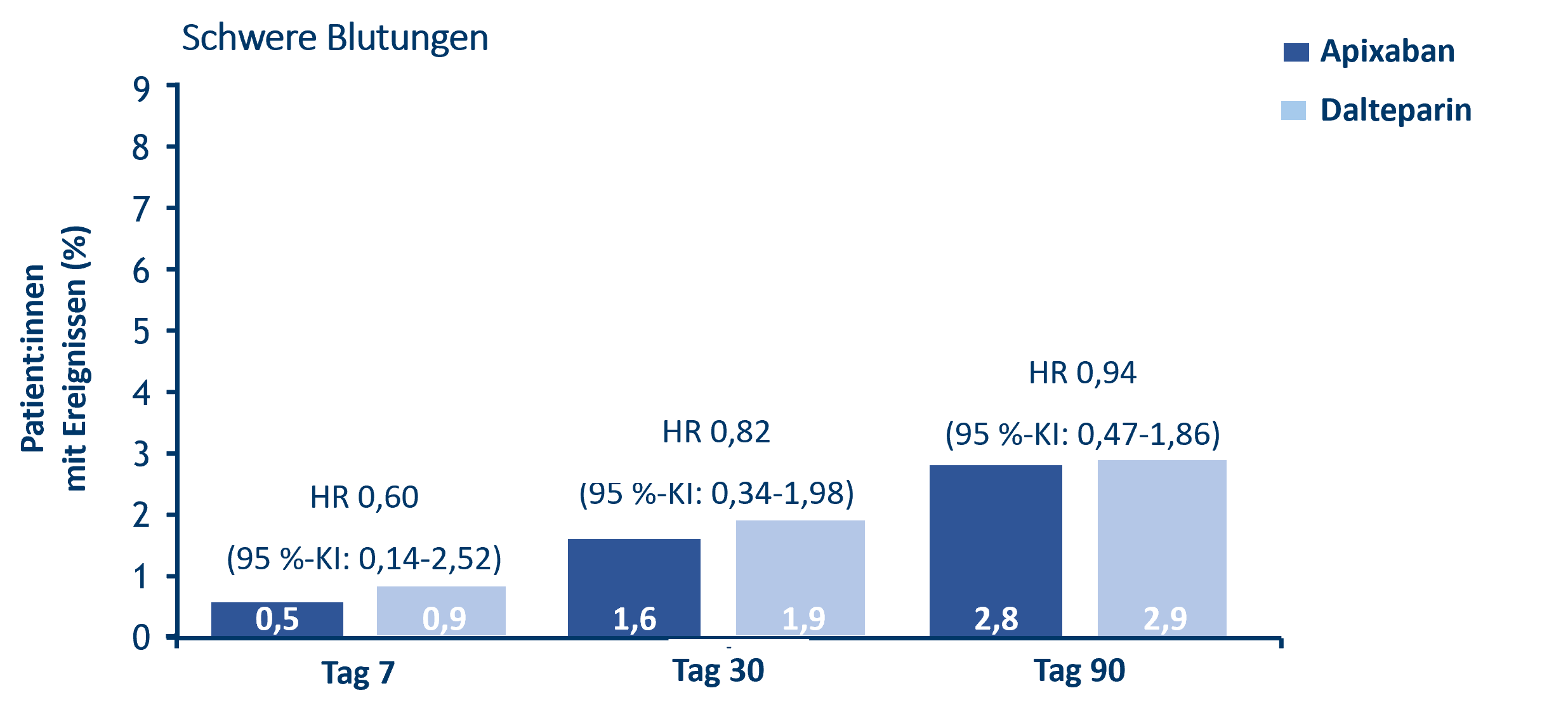
CARAVAGGIO-Subanalyse: Schwere Blutungen‡ unter Apixaban versus Dalteparin, modifiziert nach Cohen et al.11
Fazit:
Die Daten nach 6-monatiger Antikoagulation aus der CARAVAGGIO-Studie zeigen, dass Apixaban für ein breites Kollektiv an VTE-Krebspatient:innen angewendet werden kann. Dies inkludiert Hochrisiko-Patient:innen mit gleichzeitiger Krebsbehandlung, mit GI-Tumoren oder moderater Nierenfunktionsstörung (eGFR < 60 ml/min und ≥ 30 ml/min).4–7 Darüber hinaus komplementieren Analysen aus dem Versorgungsalltag§ die Ergebnisse bei einer 6-monatigen Apixaban-Behandlung.9 Nun unterstützen die Ergebnisse einer neuen Subanalyse der CARAVAGGIO-Daten die frühe Anwendung von Apixaban zur Behandlung der krebsassoziierten VTE.11 Diese zeigen, dass Apixaban sowohl in der initialen 7-tägigen VTE-Behandlung mit der Hochdosis (10 mg 2x täglich)* als auch in der weiteren VTE-Behandlung nach dem ersten bzw. dem dritten Monat unter Apixaban 5 mg 2x täglich bzgl. Wirksamkeit und Sicherheit vergleichbar zu NMH ist.11
* Bei der Behandlung der VTE mit ELIQUIS® gibt es keine Dosisreduktionskriterien in Bezug auf Alter, Nierenfunktion oder Gewicht. Bei Patient:innen mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance 15 – 29 ml/min) sollte ELIQUIS® nur mit entsprechender Vorsicht eingesetzt werden. Bei Patient:innen mit einer Kreatinin-Clearance < 15ml/min oder bei dialysepflichtigen Patienten wird ELIQUIS® nicht empfohlen. Kontraindikationen und weitere Hinweise zur Anwendung von ELIQUIS® sind der aktuellen Fachinformation zu entnehmen.
† Aktive: Diagnose innerhalb der letzten 6 Monate oder Behandlung zum Zeitpunkt des Studieneinschlusses oder innerhalb von 6 Monaten vor Randomisierung oder rezidivierende, lokal fortgeschrittene oder metastasierte Krebserkrankung; frühere: Diagnose innerhalb der letzten 2 Jahre.
‡ EMA-Definition: schwere Blutungen nach Kriterien der International Society on Thrombosis and Haemostasis
(ISTH) und Blutungen, die einen akuten chirurgischen Eingriff erfordern.
§ Limitationen:• Beobachtungsstudien zeigen nur Assoziationen zwischen Variablen, keine Kausalität.• Die Definitionen von VTE-Rezidiven basierte auf der stationären Diagnose nach ICD-9/10-CM für VTE mit positiver Risikoabschätzung (26–93 %). Patient:innen mit anderen Hospitalisierungsgründen und VTE wurden dadurch nicht ausgeschlossen.• Hämoglobinwerte waren nicht verfügbar, daher ist es theoretisch möglich, dass nicht alle schweren Blutungen erfasst wurden. • Die ICD-Codes und der Algorithmus zur Identifikation von CRNM-Blutungen sind nicht in der Literatur validiert. Eine Fehleinschätzung aufgrund falscher Klassifizierung ist möglich. • Das Poolen der Datensätze ermöglicht keinen Ausschluss von Duplikaten. Schätzungen in der Literatur gehen von nur 0,5 % Duplikaten aus.• Wie bei jeder Versicherungsdatenbank besteht die Möglichkeit von Kodierungsfehlern und fehlenden Daten.• Es wurden 52 Patient:innen mit VTE-Rezidiven während der Überbrückungsphase mit NMH vor Warfarin ausgeschlossen.• Kommerzielle Datenbanken enthalten keine Informationen zu Todesfällen wie fatalen VTE-Rezidiven.• Die Ergebnisse treffen unter Umständen nur auf die erfasste Population (privat krankenversicherte US-Amerikaner:innen) zu.• Bestimmte Daten wie z. B. Laborparameter sind bei den Versicherungsdaten nicht verfügbar.• In den Datensätzen sind Verschreibungen von Medikamenten während der Hospitalisierung nicht identifizierbar.
** Die Wirksamkeitsanalyse umfasste Daten von Patient:innen aus der Intention-to-treat-Population mit einem dokumentierten VTE-Rezidiv 7, 30 und 90 Tage nach der Randomisierung. Die Sicherheitsanalyse umfasste Daten, die im Zeitraum von der Verabreichung der ersten Dosis des Studienmedikaments bis 48 Stunden nach der letzten Dosis, erfasst wurden.11
- Chew HK et al. Incidence of venous thromboembolism and its effect on survival among patients with common cancers. Arch Intern Med 2006; 166(4):458–64.
- Khorana AA et al. Thromboembolism is a leading cause of death in cancer patients receiving outpatient chemotherapy. J Thromb Haemost 2007; 5(3):632–4.
- Prandoni P et al. Recurrent venous thromboembolism and bleeding complications during anticoagulant treatment in patients with cancer and venous thrombosis. Blood 2002; 100(10):3484–8.
- Agnelli G et al. Apixaban for the Treatment of Venous Thromboembolism Associated with Cancer. N Engl J Med 2020; Apr 23;382(17):1599-1607.
- Verso M et al. Effects of concomitant administration of anticancer agents and apixaban or dalteparin on recurrence and bleeding in patients with cancer-associated venous thromboembolism. Eur J Cancer 2021; 148:371–81.
- Ageno W et al. Bleeding with Apixaban and Dalteparin in Patients with Cancer-Associated Venous Thromboembolism: Results from the Caravaggio Study. Thromb Haemost 2021; 121(05):616–24 [eingesehen am 1/13/2021].
- Becattini C et al. Renal function and clinical outcome of patients with cancer-associated venous thromboembolism randomized to receive apixaban or dalteparin. Results from the Caravaggio trial. Haematologica 2022; 107(7):1567–76.
- Stevens SM et al. Antithrombotic Therapy for VTE Disease: Second Update of the CHEST Guideline and Expert Panel Report - Executive Summary. Chest 2021; 160(6):2247–59.
- Cohen A et al. Effectiveness and Safety of Apixaban, Low-Molecular-Weight Heparin, and Warfarin among Venous Thromboembolism Patients with Active Cancer: A U.S. Claims Data Analysis. Thromb Haemost 2021; 121(3):383–95.
- Cohen AT et al. Effectiveness and safety of apixaban, LMWH, and warfarin among high-risk subgroups of VTE patients with active cancer. Curr Med Res Opin 2021:1–16.
- Cohen AT et al. Early Time Courses of Recurrent Venous Thromboembolism and Bleeding during Apixaban or Dalteparin Therapy for Patients with Cancer. Thromb Haemost 2024.

