Therapieziele bei axSpA°: Was können TNFi und IL-17i leisten?
Therapieoptionen bei axSpA: TNFi oder IL-17i? Welche Relevanz hat der CRP-Wert als Entscheidungshilfe? Eine neue Post-hoc-Auswertung zeigt eine höhere Wirksamkeit des IL-17-Inhibitors Taltz<sup>®</sup> bei normalem und erhöhtem CRP.<sup>1</sup> Erfahren Sie, wie Taltz<sup>®</sup> auch langfristig überzeugt. Mehr zu den Studienergebnissen hier.
axSpA-Therapie: Die Suche nach der passenden Strategie
Die gemeinsamen Leitlinien von ASAS und EULAR (2022 aktualisiert) empfehlen zur Behandlung von axSpA° nach NSAR-Versagen eine Eskalation auf TNF-, IL-17- oder JAK-Inhibitoren. Die gängige Praxis ist der Einsatz eines TNFi oder IL-17i. Als Ziel soll sich der ASDASa innerhalb von 12 Wochen um mindestens 1,1 Punkte verbessern.2 Mehr zu den aktuellen Leitlinienempfehlungen lesen Sie hier.
Therapieoptionen individualisieren
Vorhersagemodelle zur Wirksamkeit einer Therapie können den Behandelnden eine Hilfestellung geben, ob TNFi oder IL-17i die bessere Option ist. Hierzu kann der CRP-Wert herangezogen werden, wie die Leitlinien beschreiben.2 Denn: ein erhöhter CRP-Wert gilt als stärkster Prädiktor für ein Ansprechen auf TNFi.
Das Problem dabei: Bei vielen Patient:innen (21 bis 59 %, je nach Datengrundlage aus verschiedenen Real-World-Registern) ist der CRP-Wert trotz aktivem Krankheitsgeschehen nicht erhöht.3-10
Die Krankheitslast bei Betroffenen mit normalem CRP-Wert ist jedoch vergleichbar mit der bei erhöhtem CRP.11,12
Ein normaler CRP-Wert ist einer der wichtigsten Prädiktoren für ein niedriges Ansprechen auf TNFi.13-15
IL-17i besser als TNFi bei normalem und erhöhtem CRP
Eine aktuelle Post-hoc-Auswertung der COAST-V-Studie stratifiziert die Ergebnisse für ein BASDAI50b- bzw. ASDAS-Ansprechen bezüglich der initialen CRP-Werte der Teilnehmenden. Verglichen wurden die Therapien mit dem IL-17i Taltz®, dem TNFi Adalimumab und Placebo (Abb. 1).1
- In der Gruppe der Teilnehmenden mit normalem CRP-Wert erreichten mit Taltz® mehr Patient:innen ein ASDAS-Ansprechen (ASDAS < 2,1) als mit Adalimumab (46 % vs 35 %). Ein BASDAI50-Ansprechen erreichten mit Taltz® 35 % vs 24 % mit Adalimumab.
- Auch in der Gruppe der Patient:innen mit erhöhtem CRP-Wert erreichten mehr Patient:innen mit Taltz® ein Therapieansprechen (ASDAS < 2,1 und BASDAI 50) als mit Adalimumab.
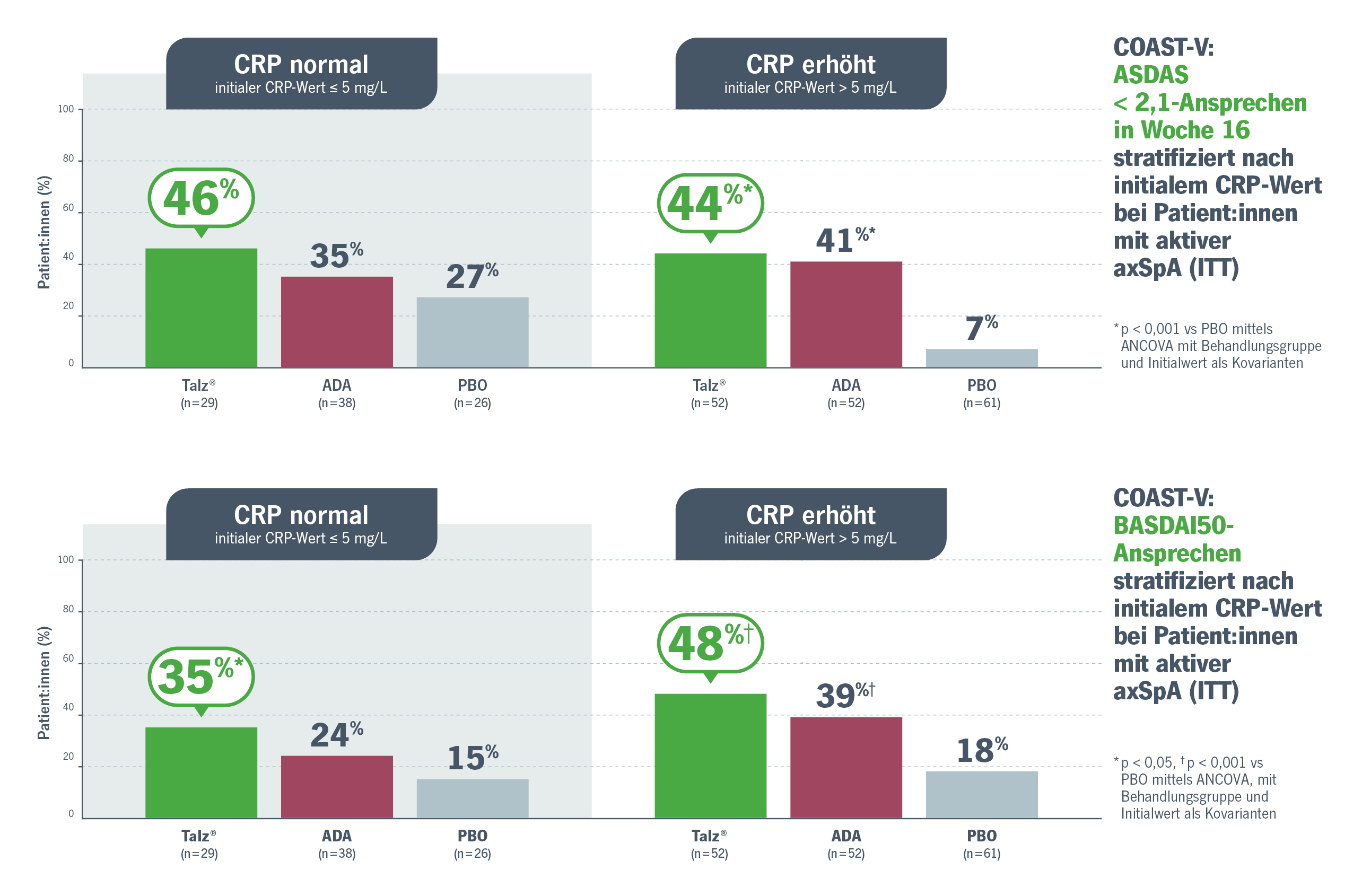
Abb. 1. Ergebnisse der Post-hoc-Auswertung zum Vergleich des Therapieansprechens in den beiden Gruppen: Teilnehmende mit normalem bzw. erhöhtem CRP-Wert. Modifiziert nach Sengupta R, et al. 2024.1
In diesem Kurzvideo erläutert der Rheumatologe Dr. Raj Sengupta, Vereinigtes Königreich, die CRP-unabhängige Wirksamkeit von Taltz® bei Patient:innen mit aktiver axSpA für Sie:

Den Blick nach vorn richten: Hält die Wirksamkeit auf lange Sicht an?
Für die Lebensqualität der Betroffenen und die Therapieadhärenz ist es von großer Bedeutung, dass die Wirksamkeit einer Behandlung auch langfristig anhält.
Für Taltz® konnte in der COAST-Y-Studie eine gute Langzeitwirksamkeit gezeigt werden:
Im dritten Jahr der Therapie hielten 7 von 10 Patient:innnen ein ASAS40-Ansprechen aufrecht17-19 und sind damit in Remission oder haben eine geringe Krankheitsaktivität.
Auf einen Blick:
- Bis zu 59 % der Patient:innen mit aktiver axSpA haben normale CRP-Werte.3-10
- Die Krankheitslast bei normalen und erhöhten CRP-Werten ist ähnlich hoch.11,12
- Ein normaler CRP-Wert ist ein Prädiktor für ein niedriges Ansprechen auf TNFi.13-15
-
Taltz® erreichte ein gutes Ansprechen bei aktiver axSpA sowohl bei normalem als auch bei erhöhtem CRP-Wert.1,16
- Taltz® wirkt langanhaltend: Auch nach 3 Jahren waren Betroffene weiterhin in Remission oder hatten eine geringe Krankheitsaktivität.17-19
° Axiale Spondyloarthritis (axSpA): Ankylosierende Spondylitis (röntgenologische axiale Spondyloarthritis): Taltz® (Ixekizumab) ist angezeigt für die Behandlung erwachsener Patienten mit aktiver röntgenologischer axialer Spondyloarthritis (r-axSpA), die auf eine konventionelle Therapie unzureichend angesprochen haben. Nicht-röntgenologische axiale Spondyloarthritis (nr-axSpA): Taltz® (Ixekizumab) ist angezeigt für die Behandlung erwachsener Patienten mit aktiver nicht-röntgenologischer axialer Spondyloarthritis mit objektiven Anzeichen einer Entzündung, nachgewiesen durch erhöhtes C-reaktives Protein und/oder Magnetresonanztomographie, die unzureichend auf nichtsteroidale Antirheumatika angesprochen haben.
a ASDAS: Ankylosing Spondylitis Disease Activity Score
b BASDAI: Bath Ankylosing Spondylitis Disease Activity Index
c ASAS: Assessment of SpondyloArthritis international Society
TNFi: Tumornekrosefaktor-Inhibitoren
IL-17i: Interleukin-17-Inhibitoren
CRP: C-reaktives Protein
JAK: Januskinasen
ASAS: Assessment of Spondyloarthritis International Society
EULAR: European Alliance of Associations for Rheumatology
NSAR: Nichtsteroidale Antirheumatika
- Sengupta R, et al. Poster presented at ACR 2024. P1475.
- Ramiro S, et al. Ann Rheum Dis 2023:82:19–34.
- Zhao S, et al. Rheumatology (Oxford) 2019;58:811–9.
- Ørnbjerg LM, et al. Ann Rheum Dis 2019;78:1536–44.
- Kishimoto M, et al. RMD Open 2021;7e001752.
- Molto A, et al. Ann Rheum Dis 2016;75:1016–23.
- Poddubnyy D, et al. Rheumatology (Oxford) 2022;61:3299–308.
- van den Berg R, et al. Ann Rheum Dis 2013;72:1646–53.
- Dougados M, et al. Joint Bone Spine 2015;82:345–51.
- Mease PJ, et al. Arthritis Care Res 2018;70:1661–70.
- Poddubnyy D, et al Ann Rheum Dis 2010;69;1338–41.
- Sengupta R, et al. Poster presented at ICS 2024.P-96.
- Rudwaleit M, et al. Ann Rheum Dis 2004;63:665–70.
- Vastesaeger N, et al. Ann Rheum Dis 2011;70:973–81.
- Wang R, et al. JAMA Netw Open 2022;5:e222312.
- Maksymowych WP, et al. Rheumatology (Oxford) 2022;61:4324–34.
- van der Heijde D, et al. Lancet 2018;392:2441–51.
- Deodhar A, et al. J Rheumtol 2023;50:1020–8.
- Brandt J, et al. Ann Rheum Dis 2004;63:1438–44.
PP-IX-DE-4958

